
المهندس عبد القادر ميمه
الطباعة الحيويَّة ثلاثيَّة الأبعاد للأعضاء البشريَّة:
الأسّس التقنيَّة والتطبيقية
الملخص:
تُعَد الطباعة الحيويَّة ثلاثيَّة الأبعاد أحد التطورات الرائدة في مجال التقانات الحيويَّة الطبية، إذ تُتيح هذه التكنولوجيا الإمكانية لإنتاج أعضاء ونُسج حيويَّة من خلايا حيّة مُستقلة تتوافق مع جسم الإنسان بشكل دقيق وفعَّال. تعتمد هذه التقنية على الدمج بين مفاهيم التصوير ثلاثي الأبعاد والمحاكاة الرقميَّة وتصميم أنسجة معقدة، بهدف خلق هياكل وظيفية تحاكي الأعضاء الطبيعية وتتجاوز القيود التقليديَّة لزراعة الأعضاء التقليديَّة. يُعد فهم الأسس البيولوجية والتقنية اللازمة لإنتاج الأنسجة الحيويَّة من أبرز العوامل التي تسهم في تطور هذه التقنية، فهي تتطلب اختيار مواد حيويَّة مناسبة تضمن السلامة والوظائف الحيويَّة للنسج المُطبوعة. كما أن تقنيات الإسناد الحيوي وتشكيل الأعضاء، مثل طبقات الخلايا وتقنيات الزرع، تلعب دورًا رئيساً في ضمان دقة التصنيع وتماسك الهيكل النهائي، مع مراعاة أهمية التصوير والتقييم المبدئي لضمان الجودة والكفاءة. إذ يعتمد نجاح إنشاء الأعضاء ثلاثيَّة الأبعاد بشكل كبير على تصميم النسخ الرقمية وترتيب الخلايا بشكل استراتيجي، فضلاً عن تدعيم الوظائف الحيويَّة من خلال إضافة الأوعية الدموية والأعصاب لضمان الاستدامة والوظائف طويلة الأمد. يواجه تطبيق هذا المجال عدة تحديات، من بينها ضمان التوافق المناعي، والتحكم في البيئة الدقيقة للنسج المطبوعة، بالإضافة إلى تقنيات التحفيز البيولوجي لتحقيق التجاوب المطلوب. مع استمرار التقدم، تظهر إمكانات واسعة في مجالات إعادة تشكيل الأعضاء، وتصنيع نماذج بحثية لاختبار الأدوية، وتطوير تقنيات التشخيص والعلاج الموجه، مما يمهد الطريق لثورة حقيقية في الرعاية الصحية المستقبلية.
1. مقدمة:
تُعَد الطباعة الحيويَّة ثلاثيَّة الأبعاد أحد التطورات الرائدة في مجال التقانات الحيويَّة الطبية، إذ تُتيح هذه التكنولوجيا الإمكانية لإنتاج أعضاء ونُسّج حيويَّة من خلايا حيّة مُستقلة تتوافق مع جسم الإنسان بشكل دقيق وفعَّال. تعتمد هذه التقنية على الدمج بين مفاهيم التصوير ثلاثي الأبعاد والمحاكاة الرقميَّة وتصميم أنسجة معقدة، بهدف خلق هياكل وظيفية تحاكي الأعضاء الطبيعية وتتجاوز القيود التقليديَّة لزراعة الأعضاء التقليديَّة. يُعد فهم الأسس البيولوجية والتقنية اللازمة لإنتاج الأنسجة الحيويَّة من أبرز العوامل التي تسهم في تطور هذه التقنية، فهي تتطلب اختيار مواد حيويَّة مناسبة تضمن السلامة والوظائف الحيويَّة للنسج المُطبوعة. كما أن تقنيات الإسناد الحيوي وتشكيل الأعضاء، مثل طبقات الخلايا وتقنيات الزرع، تلعب دورًا رئيساً في ضمان دقة التصنيع وتماسك الهيكل النهائي، مع مراعاة أهمية التصوير والتقييم المبدئي لضمان الجودة والكفاءة. إذ يعتمد نجاح إنشاء الأعضاء ثلاثيَّة الأبعاد بشكل كبير على تصميم النسخ الرقمية وترتيب الخلايا بشكل استراتيجي، فضلاً عن تدعيم الوظائف الحيويَّة من خلال إضافة الأوعية الدموية والأعصاب لضمان الاستدامة والوظائف طويلة الأمد. يواجه تطبيق هذا المجال عدة تحديات، من بينها ضمان التوافق المناعي، والتحكم في البيئة الدقيقة للنسج المطبوعة، بالإضافة إلى تقنيات التحفيز البيولوجي لتحقيق التجاوب المطلوب. مع استمرار التقدم، تظهر إمكانات واسعة في مجالات إعادة تشكيل الأعضاء، وتصنيع نماذج بحثية لاختبار الأدوية، وتطوير تقنيات التشخيص والعلاج الموجه، مما يمهد الطريق لثورة حقيقية في الرعاية الصحية المستقبلية [1].
2. الطباعة الحيويَّة ثلاثيَّة الأبعاد:
تُعرف الطباعة الحيويَّة ثلاثيَّة الأبعاد بأنها تقنية مُتقدمة تتيح إنشاء نماذج حيويَّة معقدة تتشابه في خصائصها البنيوية والوظيفية مع الأنسجة والأعضاء البشريَّة الحقيقية من خلال استخدام عمليات التصنيع الرقمي. تعتمد هذه التقنية على بناء الأعضاء بشكل طبقات متتالية من مواد حيويَّة قابلة للتكيف، والتي يتم تحديدها وتصميمها مسبقًا بواسطة برامج حاسوبية متطورة. تشمل عملية الطباعة الحيويَّة استخدام معدات متخصصة تقوم بحقن أو ترسيب مواد حيويَّة، مثل الخلايا والهياكل الداعمة، بطريقة منتظمة ودقيقة للغاية، مع مراعاة الترتيب الوظيفي والهيكلي لكل مكون [2،1].
يقوم العلماء بتطوير نماذج ثلاثيَّة الأبعاد استنادًا إلى البيانات الرقمية المأخوذة من التصوير التشخيصي، بهدف إعادة خلق بنية تشريحية دقيقة، إذ تكون مناسبة للزراعة أو الاستخدامات البحثية. وتعتمد هذه العملية على اختيار مواد حيويَّة تتسم بمرونة عالية، وقابلية للتحلل، وتوافق بيولوجي، لضمان استمرارية الوظائف الحيويَّة للأعضاء المطبوعة [3].
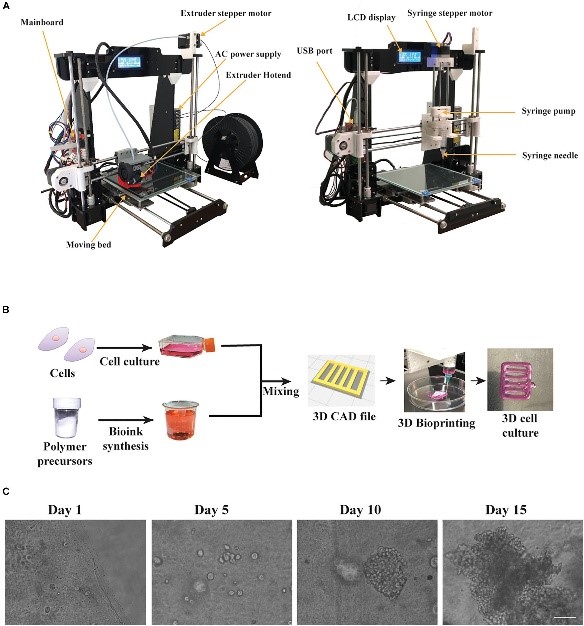
2. تاريخ وتطور تقنية الطباعة الحيويَّة ثلاثيَّة الأبعاد:
تعود جذور تقنية الطباعة الحيويَّة ثلاثيَّة الأبعاد إلى العقود الأخيرة من القرن العشرين، إذ شهدت هذه التقنية تطوراً ملحوظاً مع تطور قدرات الحواسيب وتقنيات التصوير الحيوي. ففي أوائل القرن الواحد والعشرين، بدأت المبادرات البحثية تتجه نحو استغلال إمكانات الطباعة ثلاثيَّة الأبعاد لإنشاء هياكل حيويَّة وعضوية مركبة، مدفوعة برؤية تحقيق حلول مبتكرة لمشكلات نقص الأعضاء وزيادة الحاجة إلى بدائل طبية خلاقة. شكلت الأبحاث الأولى مرحلة تجريبية، إذ تم استخدام مواد حيويَّة بسيطة وتقنيات طباعة بسيطة نسبياً لتحقيق استنساخات أولية للأنسجة. ومع تطور تقنيات الطباعة، خاصة تقنية الطباعة القائمة على الألياف والخيوط الحيويَّة، تمكن العلماء من تصنيع هياكل أكثر تعقيداً تطابق الهياكل الطبيعية للأعضاء البشريَّة، مع تحسينات مستمرة في دقة التوجيه والتشكيل. كما أن التطور في تقنيات التصوير الحيوي، مثل التصوير بالرنين المغناطيسي والتصوير بالأشعة المقطعية، أسهم بشكل كبير في تحسين نماذج التصميم الثلاثيَّة الأبعاد ودقة استنساخ الهياكل الأصلية. بمرور الوقت، تم تطوير تقنيات الطباعة متعدد الخلايا والمواد الحيويَّة ذات الأداء المحسن، إذ أصبحت القدرة على دمج الخلايا الحية مع المواد الداعمة تتيح إنشاء نماذج حيويَّة قريبة من الوظائف الفيزيولوجية للأعضاء. هذا التقدم التكنولوجي، مدعوماً بتطور المعرفة البيولوجية والهندسيَّة ساهم في انتقال التقنية من مرحلة البحث الأساسي إلى تطبيقات سريرية أوسع، مما يعكس تراكماً مستمراً في تاريخ وتطور هذه التقنية الحيويَّة الواعدة [4].
3. الاساس البيولوجي للطباعة الحيويَّة ثلاثيَّة الأبعاد:
تقوم الأسس البيولوجية والتقنية في الطباعة الحيويَّة ثلاثيَّة الأبعاد على فهم دقيق للهياكل الخلوية والنسيجية، إذ يتم اختيار الخلايا المناسبة استنادًا إلى نوع الأنسجة المستهدفة، مع مراعاة خصائصها الوظيفية والبيوكيميائية. يعتمد تحديد نوعية الخلايا على مصادرها، سواء كانت خلايا جذعية أو خلايا متخصصة، مما يتيح إمكانية استنساخ أنسجة وظيفية تتوافق مع الحاجة الطبية المحددة. بالإضافة إلى ذلك، يلعب تصميم المواد الحيويَّة دورًا حيويًا في نجاح التقنية، إذ يتم تطوير مواد بيولوجية تجمع بين المرونة والمتانة، مع خصائص حيويَّة تعزز تجانسها مع الأنسجة المجاورة وتحفز عمليات النمو والتجدد الخلوي [5].
تُعد تقنيات الإسناد الحيوي وتشكيل الأعضاء من العوامل الأساسية التي تعتمد على استخدام نماذج رقمية متقدمة، إذ يتم برمجتها وتصميمها مسبقًا لضمان توزيع دقيق للخلايا والمواد، مع الأخذ في الاعتبار توزيع الأوعية الدموية والأعصاب اللازمة لضمان الوظائف الفيزيولوجيَّة. تتيح تقنيات التصوير والتقييم المبدئي مراقبة الجودة وسلامة الأعضاء المطبوعة، بالإضافة إلى تقييم مدى توافقها مع البنى الحيويَّة المجاورة من خلال تقنيات التصوير عالية الدقة مثل الأشعة المقطعية والرنين المغنطيسي [6،1].
يعتمد نجاح هذه العمليات على تقنيات متطورة تشمل التصميم الرقمي الدقيق للنُسخ الحيويَّة، واستراتيجيات ترتيب الخلايا بطريقة تضمن ترويج التمايز والتنسيق بين الأنسجة. كما تُستخدم تقنيات الزرع والتحفيز البيولوجي لتعزيز استدامة النمو والتعويض الطبيعي، مع التركيز على تدعيم الوظائف الحيويَّة والأوعية الدموية لضمان تزويد الأعضاء بالطاقة والعناصر الضرورية. إنَّ فعاليَّة هذه التداخلات تتطلب تكييفاً دقيقًا لظروف البيئة الدقيقة لضمان عدم حدوث الرفض المناعي، واستدامة الوظائف على المدى الطويل، وهو ما يمثل تحديًا علميًا وتقنيًا رئيساً يتطلب المزيد من البحث والتطوير المستمر [6].
4. مكونات نظام الطباعة ثلاثي الأبعاد:
يتكون النظام ثنائي-ثلاثي الأبعاد من مجموعة من العناصر التقنية والحيويَّة التي تتيح إنشاء هياكل ثلاثيَّة الأبعاد دقيقة وفعالة للأعضاء البشريَّة. يُعدّ العنصر الأساسي في هذا النظام هو البرنامج الحاسوبي الذي يقوم بتصميم وتحليل النماذج الحيويَّة بشكل رقمي، معتمدًا على تقنيات النمذجة ثلاثيَّة الأبعاد التي تسمح بخلق تصاميم دقيقة تتوافق مع متطلبات الوظيفة التشريحية والوظيفية للعضو المطلوب. يُستخدم هذا التصميم الرقمي كنموذج مرجعي يُوجه عملية الطباعة الفعلية.
أما المكون الثاني، فهو آلة الطباعة الحيويَّة ثلاثيَّة الأبعاد التي تُعد الأداة الرئيسة في بناء الأعضاء، وتستخدم تقنيات مختلفة مثل الطباعة الحرارية، والطباعة بالمواد الحيويَّة، والطباعة بالليزر لتحقيق الدقة والتعقيد في تشكيل الهياكل. تعتمد هذه الآلات على رؤوس طباعة مبرمجة خصيصاً لترتيب وتكديس الخلايا والمواد الحيويَّة بشكل دقيق في المكان الصحيح، مما يضمن تكامل الأنسجة والأوعية الدموية والتجاويف الحيويَّة الضرورية لعمل العضو الطبيعي بشكل فعال.
كما يتطلب النظام أداة للاستنساخ والتحكم في عمليات الإسناد الحيوي، والتي تُمكّن من تعزيز الترابط بين الخلايا المحفّزة، وتحقيق توزيع متجانس للخلايا والأوعية الدموية. يُعتمد في ذلك على تقنيات حديثة مثل الطباعة الحية بالليزر أو الطباعة الحيويَّة بالمواد المفلورة، التي تُمكّن من تشكيل هياكل تتوافق مع خصائص الأنسجة الأصلية، مع الحفاظ على التكامل الوظيفي الحيوي طويل الأمد [7].
5. آلية اختيار المواد الحيويَّة:
يتطلب اختيار المواد الحيويَّة في الطباعة الحيويَّة ثلاثيَّة الأبعاد اعتبارات متعددة تتعلق بالخصائص الفيزيائية والكيميائية والبيولوجية للمواد المستخدمة. يجب أن تتوافق المواد مع متطلبات البيئة الداخلية للجسم من حيث التوافق المناعي والمرونة والقدرة على دعم نمو الخلايا وتكامل الأنسجة. تتسم المواد الحيويَّة المثالية بخصائص حيويَّة تسمح بتشجيع النمو والتمايز الخلوي، بالإضافة إلى مقاومة الهدم والتمدد، لضمان استدامة الأعضاء المطبوعة على المدى الطويل [8].
من ناحية أخرى، يتم تصنيف المواد الحيويَّة تحت فئة المواد الحيويَّة الاصطناعية والطبيعية، إذ تتقدم المواد الاصطناعية في مجالات المرونة وإمكانية التخصيص، فيما توفر المواد الطبيعية تكاملاً أفضل مع الأنسجة الحية نظرًا لتشابهها الخلوي والكيميائي مع مكونات الجسم. ويتم اختيار المواد بناءً على مستوى تفاعلها الحيوي، وقدرتها على دعم التروية الدموية، ومرونتها، ومدى مقاومتها للجفاف والتدهور [9،5].
علاوة على ذلك، يُؤخذ في الاعتبار استقرار المواد أثناء عمليات الطباعة، إذ تظل قابلة للتشكيل دون فقدان خصائصها الحيويَّة، مع إمكانية إجراء التعديلات الضرورية لتلبية احتياجات الأنسجة المعنية. يسهم الابتكار في تصميم مواد حيويَّة قابلة للتحلل الحيوي وتدعم تكامل الخلايا مع الهيكل المطبوع، مما يقلل من احتمالات رفض الجسم ويعزز تكامل الأعضاء بعد الزرع [10].
وفي السياق ذاته، يتطلب اختيار المواد الحيويَّة توافقها مع التقنيات المطبوعة المختلفة، إذ أن بعض المواد تتطلب ظروف طباعة خاصة لضمان تماسكها وفعاليتها الوظيفية. الأبحاث المستمرة في هذا المجال تركز على تطوير مواد جديدة وملائمة، تجمع بين الخصائص الفيزيائية والبيولوجية المطلوبة، بهدف تعزيز أداء الأعضاء المزروعة وتحقيق نتائج علاجية متميزة [9].
6. استراتيجيات ترتيب الخلايا وتوليد النسخ:
تعد استراتيجيات ترتيب الخلايا وتوليد النسخ من الركائز الأساسيَّة في عملية الطباعة الحيويَّة ثلاثيَّة الأبعاد للأعضاء البشريَّة، إذ تتطلب دقة عالية في تنظيم الخلايا وتوجيهها لتحقيق وظائف متعددة ومتنوعة. يتطلب ذلك تحديد مواضع الخلايا بدقة متناهية، مع مراعاة التفاعلات الحيويَّة والسلوكيات البيولوجية، لضمان تجانس النسيج وتكامله مع البنى المحيطة. أحد الأساليب الشائعة يتضمن استخدام نماذج حوسبة دقيقة تتيح تصور ترتيب الخلايا قبل عملية الطباعة، مما يعزز من احتمالية النجاح ويقلل من الأخطاء.
تقوم تقنية توليد النسخ على عدة استراتيجيات، تتنوع بين الطباعة المباشرة والتقنيات غير المباشرة، مثل الطباعة بطرق النشر أو الافتتاح الدقيق. تعتمد بعض الطرق على استخدام رؤوس طباعة متخصصة تقوم بوضع الخلايا غير معرضة للتلف، فيما تُستخدم أخرى تقنيات تعتمد على التصلب الانتقائي أو التوجيه الحراري، بهدف بناء هياكل معقدة تتوافق مع خصائص الأعضاء المراد تصنيعها. تشتمل توجيهات الترتيب على اختيار الخلايا المناسبة لكل نوع من الأنسجة، إذ تزيد التقنية من قدرة الأعضاء على أداء وظائفها الحيويَّة بعد الزرع.
كما يُعتمد على توليد النسخ باستخدام تقنيات تتيح تكرار العملية بشكل منظم ومتكرر، مما يسهم في بناء هياكل متعددة الطبقات ومعقدة، تحاكي حجم وتركيب الأنسجة البشريَّة بشكل دقيق. تشمل التقنيات الحديثة أنظمة التوجيه الذكية التي تعتمد على الذكاء الاصطناعي، لضمان تحكم دقيق في عملية البناء، ومن ثم تحسين التطابق مع المواصفات الأنفية للمريض. يُعد توليد النسخ جزءًا محوريًا من تصميم الأعضاء، لما يوفره من إمكانيات لإنتاج نماذج وظيفية متعددة الحجم والخصائص، تتيح تطبيقات سريرية واسعة وتطوير علاجات أكثر تخصصًا وفعالية [11].
7. دراسة حالة:
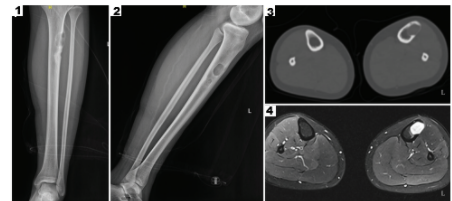
في عام 2022 تم نشر حالة عن استخدام الطباعة الحيويَّة ثلاثيَّة الابعاد لأول مرة من أجل تخليق عظام نشطة لإصلاح العيوب العظمية في مجلة (International Journal of Bioprinting) [12]، إذ راجعت مريضة عمرها 16 عاماً بآلام متقطعة في عضلة الساق اليسرى استمرت لستة أشهر. ثم تطورت الآلام في الجزء العلوي من ساقها اليسرى بعد ممارسة الرياضة متبوعة بنوبات متقطعة من الألم. كانت الكتلة الورميَّة ملموسة في الجزء العلوي من الساق بحجم (1×1 سم) بحدود غير واضحة وحركة ضعيفة وألم خفيف عند الضغط. وقد أظهرت صورة الاشعة السينية والتصوير المقطعي المحوسب لعظام الساق اليسرى كتلة تشغل الطرف العلوي من عظمة الساق اليسرى (الشكل-2 (1 و2)). أظهر التصوير بالرنين المغناطيسي MRI كتلاً متعددة مشغلة في الجزء العلوي وقد تكون حميدة (الشكل-2 (3 و4)). مما دعا لتشخيص المريضة بالإصابة بكتلة عظمية، وبعد أخذ الموافقة على إجراء طباعة حيويَّة ثلاثية الابعاد نشط كبديل للجزء المستأصل، كما تمت الموافقة على تطبيق العظم النشط المطبوع حيويًا لإصلاح عيوب العظام من قِبل لجنة الأخلاقيات في مستشفى الشعب التاسع التابع لكُلِّيَّة شنغهاي جياو تونغ للطِّبِّ
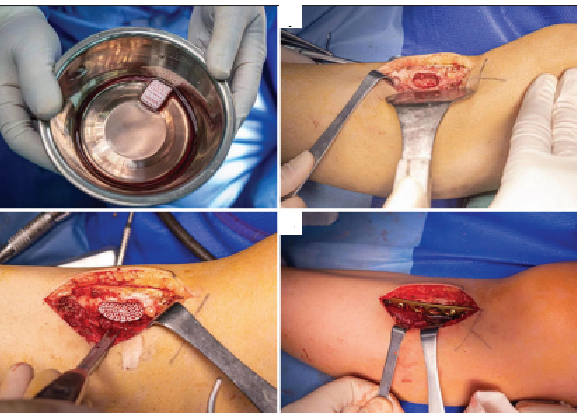
تم تصميم وطباعة العظم النشط المطبوع حيويًا باستخدام بيانات التصوير المقطعي المحوسب CT المأخوذة قبل الجراحة (الشكل 3)، وأُجريت الطباعة كاملة في مختبر GMP. سُحب حوالي 35 مل من الدم الوريدي الطرفي من المريضة قبل الجراحة، وأُعدّ حوالي 4 مل من بلازما مصل الصفائح الدموية PRP بعمليتي طرد مركزي. ثم طُبِعَتْ مادّة بولي كابرولاكتون/بيتا-تري كالسيوم فوسفات طبقة بطبقة عبر قناتين للحصول على عظم نشط مطبوع حيويًا بمساميّة حوالي 55% (الشكل 3أ)، ثم وُضِعَ في محلول ملحي طبيعي للاستخدام لاحقًا.

خلال العملية، أُجريَ شقّ طولي على الجانب الأمامي الجانبي للجزء العلوي من عظمة الساق اليسرى، وفُصِلَ طبقة بطبقة، وبعد كشف منطقة الورم في الجزء العلوي من عظمة الساق، حُفِرَ ثقب وأُزِيلَتِ الآفات باستخدام الكريت، وقد كانت آفات الورم بحجم حوالي 3 سم × 2.5 سم × 2 سم، بلون رمادي أبيض وملمس متوسط. أُزِيلَ نسيج الحائط الداخلي لعظمة الساق بمثقاب طحن وغُسِلَ مرارًا بـبيروكسيد الهيدروجين والمحلول الملحي الطبيعي، أُخِذَتْ هيكل عظم نشط PCL/β-TCP/PRP وزُرِعَ في عيب عظمة الساق العلوي، وزرِعَتْ صفيحة تثبيت عظمية بـ 8 ثقوب خارجيًا متبوعة بتثبيت بالبراغي (الشكل 4).
8. التحديات العلمية والتقنية:
تُعد التحديات العلمية والتقنية في مجال الطباعة الحيويَّة للأعضاء البشريَّة من العقبات الكبرى التي تلزم الباحثين والمهنيين تطوير حلول مبتكرة للتغلب عليها. إذ يتطلب تحقيق وظائف حيويَّة كاملة قدرًا عاليًا من التنسيق بين الخلايا، والهياكل الداعمة، والأوعية الدموية والجهاز العصبي، وهو ما يمثل تحديًا كبيرًا في تصميم النسخ الحيويَّة المطبوعة بدقة عالية. كما أن استدامة الوظائف الحيويَّة على المدى الطويل تتطلب تطوير مواد حيويَّة تمتاز بالمتانة والمرونة، بما يتيح ترميم الأنسجة بشكل مستدام، مع تقليل احتمالات فقدان الوظيفة أو التصاق الأنسجة المعدلة بمناطق غير مرغوبة.
كما أن التوافق المناعي يمثل قلقًا كبيرًا، إذ ينبغي تقليل احتمالية الرفض المناعي عبر استخدام مواد حيويَّة ذات مفعول بيولوجي متوافق مع جسم المستلم، أو من خلال عمليات التخصيص المجهري. إضافة إلى ذلك، فإن إجراء التعديلات الدقيقة على النسخ المطبوعة من أجل تحسين الأداء الوظيفي، يتطلب تقنيات متطورة للتحكم في نمو وتكامل الخلايا، مع ضمان عدم حدوث تشوهات أو تلف في الأنسجة.
وفيما يخص البيئة الدقيقة، فتستلزم الدراسة والتنظيم الدقيق لظروف النمو الحيويَّة داخل المختبر لضمان تكرار النتائج وتحقيق استقرار بيولوجي.
وفيما يخص البيئة الدقيقة، فتستلزم الدراسة والتنظيم الدقيق لظروف النمو الحيويَّة داخل المختبر لضمان تكرار النتائج وتحقيق استقرار في الأداء الوظيفي، وهو ما يواجه قيودًا في التحكم التام بجميع المتغيرات المادية والبيولوجية. علاوة على ذلك، يتطلب دمج الأعصاب والأوعية الدموية بنجاح ضمن النسخ المطبوعة تداخلًا متعدد التخصصات، من علم الأحياء الدقيقة إلى الهندسة الطبية، مما يزيد من تعقيد العمليات التقنية ويستلزم أدوات متقدمة لتحسين التفاعل بين مكونات الأعضاء المطبوعة.
وفي النهاية، فإن تعزيز القدرات على الاختبار والتقييم بعد الطباعة، من خلال تقنيات تصوير دقيقة، يُعد ضروريًا لضمان سلامة وفاعلية الأعضاء المطبوعة قبل تطبيقها سريريًا، وهو ما يتطلب استثمارات ضخمة في البحث والتطوير. كل هذه التحديات تتطلب تفاعلًا مستمرًا بين العلوم الحيويَّة والهندسية، وبيئة تنظيمية مرنة تتواكب مع الابتكار، لضمان تقديم حلول فعالة ومستدامة في هذا الميدان المتطور بسرعة [13].
9. الاعتبارات الأخلاقية والتنظيمية:
تتطلب عملية الطباعة الحيويَّة ثلاثيَّة الأبعاد للأعضاء البشريَّة اعتبارات أخلاقية وتنظيمية دقيقة لضمان استخدامها بشكل مسؤول وآمن. من أبرز هذه الاعتبارات السلامة الحيويَّة، إذ ينبغي الالتزام بالمعايير الصحية والبيئية لتفادي أخطار التلوث أو انتقال العدوى، مع الامتثال للأنظمة والمعايير الدولية التي تنظم عمليات الإنتاج والتجربة. كما تبرز الحاجة إلى تنظيم استخدام الخلايا والمواد ذات الأصل البشري أو الحيواني، مع ضمان وجود موافقات تنظيمية على استثمارات البحث والتطوير السرية، على أن تتسم بالمصداقية والشفافية.
إضافة إلى ذلك، يطرح موضوع حماية البيانات الشخصية وحقوق المرضى قضية مركزية، إذ يجب ضمان سرية المعلومات الطبية والنماذج الحيويَّة المستخدمة، مع ضمان حقوق المرضى في الموافقة المستنيرة وتحديد الاستخدام المستقبلي للبيانات والأعضاء المطبوعة. من شأن ذلك أن يخفف من أخطار الاستغلال غير القانوني أو سوء الاستخدام، ويؤكد على أهمية وجود أطر تنظيمية صارمة لحماية حقوق المستخدمين والمشاركين. وعلاوة على ذلك، يتطلب تطبيق هذه التقنيات دعماً قانونياً وأخلاقياً شاملًا، بما يشمل معايير للسلامة والأمان، فضلاً عن تقييم التداعيات.
علاوة على ذلك، يتطلب تطبيق هذه التقنيات دعماً قانونياً وأخلاقياً شاملًا، بما يشمل معايير للسلامة والأمان، فضلاً عن تقييم التداعيات الاجتماعية والاقتصادية المحتملة. يجب أن تترافق السياسات التنظيمية مع نقاش مجتمعي واسع حول مسؤولية الباحثين والمؤسسات، لضمان التوازن بين الابتكار وحماية المبادئ الأخلاقية. إضافة إلى ذلك، تتطلب العملية التنسيق بين المؤسسات الحكومية والهيئات التنظيمية الدولية لوضع لوائح تتماشى مع التطورات التقنية، وتساعد على تقليل المخاطر المحتملة، بينما تلزم الجهات المعنية بالشفافية المستمرة والإبلاغ عن نتائج الأبحاث بطريقة تتسم بالمسؤولية والأخلاق [14].
10. آفاق مستقبليَّة والاتجاهات الناشئة:
تشير الاتجاهات الناشئة في مجال الطباعة الحيويَّة ثلاثيَّة الأبعاد للأعضاء البشريَّة إلى تطورات مبتكرة تُمكن من تحسين كفاءة وموثوقية العمليات التصنيعية والحيويَّة، مع التركيز على تحقيق تكامل كامل مع الجسم الحي. من المتوقع أن تتجه الأبحاث نحو تطوير مواد حيويَّة أكثر توافقًا مناعيًا وذات خصائص وظيفية متعددة، مما يعزز من استدامة الأعضاء المطبوعة على المدى الطويل ويقلل من مشكلات الرفض المناعي. يلعب الذكاء الاصطناعي وتحليل البيانات الضخمة دورًا محوريًا في تحسين تصميم النماذج الحيويَّة، عبر محاكاة دقيقة للوظائف الحيويَّة والتحليل المسبق للنتائج، مما يسهل التحقق من جودة الأعضاء قبل الزراعة. كما تتجه الأنظار نحو استخدام تقنيات الطباعة السريعة والطبقات الدقيقة لتعزيز دقة التشكيل وتحقيق تفاصيل معقدة، خاصة في الأوعية الدموية الدقيقة والهياكل العصبية، لضمان تلبية متطلبات الوظائف الحيويَّة المعقدة. على المستوى المستقبلي، من المتوقع أن تتداخل التطورات التكنولوجية مع التقدم في علم الأحياء الجزيئية والجينوم، الأمر الذي يستدعي ابتكار استراتيجيات مشتركة لضمان تفاعل متجانس بين الأنسجة المطبوعة والجهاز المناعي. يُعزز ذلك من إمكانات استنساخ أعضاء مخصصة تعتمد على بيانات الوراثة الفريدة، مما يفتح الباب أمام علاج فردي أكثر دقة وفعالية. في سياق التحديات، يتطلب ذلك توافقًا معايير تنظيمية صارمة لضمان السلامة والأمان، إضافة إلى معالجة القضايا الأخلاقية المتعلقة باستخدام الخلايا البشريَّة وتمثيلها. في ظل هذه التطورات، من المتوقع أن يشهد المجال تحولات نوعية تُسهم في إحداث نقلة نوعية في الطب التجديدي، وتوفير حلول مبتكرة لمرضى يعانون من حالات حرجة، وتقليل الاعتماد على زراعة الأعضاء التقليدية، مع استدامة طويلة الأمد وميزات وظيفية محسنة [15].
الخلاصة:
في الختام، تمثل الطباعة الحيوية ثلاثية الأبعاد نقلة نوعية في مجالات الهندسة الطبية والتجديدية، إذ تجمع هذه التكنولوجيا بين التقنيات المتقدمة والمبادئ البيولوجية لإنشاء أنسجة وأعضاء حية تشكل الأمل لعلاج الكثير من الأمراض المزمنة والمعقدة. على الرغم من التحديات التقنية والأخلاقية التي تواجه هذه التقنية، مثل ضمان استقرار الخلايا والتقليل من أخطار الأنسجة المصنعة، فإن التطورات المستمرة في مجالات الحبر الحيوي وبرمجيات الطباعة تؤكد إمكانية تحقيق نقلة حقيقية في زراعة الأعضاء وإعادة تأهيل الأنسجة. إذ أنَّ المستقبل يحمل في طياته آفاقاً واعدة توسع من إمكانيات الطباعة الحيوية، من خلال تحسين دقة الطباعة، دمج تقنيات متعددة، وتطوير مواد تدعم نمو الخلايا بشكل أفضل، مما يعزز من جدوى استخدامها في التطبيقات الطبية والعلاجية. إن الاستثمار في البحث والتطوير ضمن هذا المجال قد يفتح أبواب جديدة للطب التجديدي وتغيير حياة المرضى نحو الأفضل.
المراجع :
- Ozbolat, I. T., Moncal, K. K., & Gudapati, H. (2017). Evaluation of bioprinter technologies. Additive Manufacturing, 13, 179-200.
- Tong, A., Pham, Q. L., Abatemarco, P., Mathew, A., Gupta, D., Iyer, S., & Voronov, R. (2021). Review of low-cost 3D bioprinters: state of the market and observed future trends. SLAS TECHNOLOGY: Translating Life Sciences Innovation, 26(4), 333-366.
- Garciamendez-Mijares, C. E., Guerra-Alvarez, G. E., Sánchez-Salazar, M. G., García-Rubio, A., Garcia-Martinez, G., Mertgen, A. S., … & Alvarez, M. M. (2023). Development of an affordable extrusion 3D bioprinter equipped with a temperature-controlled printhead. J. Bioprint., 9(6), 0244.
- Fatimi, A. (2025). The History of 3D Bioprinting. In Compendium of 3D Bioprinting Technology(pp. 1-26). CRC Press.
- Daly, A. C., Prendergast, M. E., Hughes, A. J., & Burdick, J. A. (2021). Bioprinting for the biologist. Cell, 184(1), 18-32.
- Mironov, V., Reis, N., & Derby, B. (2006). Bioprinting: a beginning. Tissue engineering, 12(4), 631-634.
- Decante, G., Costa, J. B., Silva-Correia, J., Collins, M. N., Reis, R. L., & Oliveira, J. M. (2021). Engineering bioinks for 3D bioprinting. Biofabrication, 13(3), 032001.
- Li, X., Liu, B., Pei, B., Chen, J., Zhou, D., Peng, J., … & Xu, T. (2020). Inkjet bioprinting of biomaterials. Chemical reviews, 120(19), 10793-10833.
- Park, J. A., Lee, Y., & Jung, S. (2023). Inkjet-based bioprinting for tissue engineering. Organoid, 3.
- Huang, Y., Zhang, X. F., Gao, G., Yonezawa, T., & Cui, X. (2017). 3D bioprinting and the current applications in tissue engineering. Biotechnology journal, 12(8), 1600734.
- Chae, S., & Cho, D. W. (2023). Biomaterial-based 3D bioprinting strategy for orthopedic tissue engineering. Acta biomaterialia, 156, 4-20.
- Hao, Y., Cao, B., Deng, L., Li, J., Ran, Z., Wu, J., Pang, B., Tan, J., Luo, D., & Wu, W. (2022). The first 3D-bioprinted personalized active bone to repair bone defects: A case report. International journal of bioprinting, 9(2), 654.
- Murphy, S. V., De Coppi, P., & Atala, A. (2020). Opportunities and challenges of translational 3D bioprinting. Nature biomedical engineering, 4(4), 370-380.
- Patuzzo, S., Goracci, G., Gasperini, L., & Ciliberti, R. (2018). 3D bioprinting technology: scientific aspects and ethical issues. Science and engineering ethics, 24(2), 335-348.
- Kačarević, Ž. P., Rider, P. M., Alkildani, S., Retnasingh, S., Smeets, R., Jung, O., … & Barbeck, M. (2018). An introduction to 3D bioprinting: possibilities, challenges and future aspects. Materials, 11(11), 2199.
